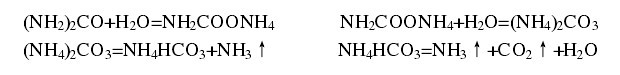氮氧化物烟气脱硝是目前NOX(NO、N2O、NO2、N2O、N2O3、N2O5等,总称NOX)污染的主要防治技术,净化处理NOX的方法可分为:还原法、吸收法、吸附法、等离子体活化法、微生物法等。此外,按治理工艺分类还可分为干法脱硝和湿法脱硝,干法脱硝包括:非催化还原法、催化还原法、热分解法、吸附法、吸收法、等离子法。湿法脱硝包括:酸吸收、碱吸收、氧化吸收、络盐吸收[1,2]。以上方法各有优缺点。
武汉某所(处于武汉市城区1类地区)在生产过程中,由于采用金属与浓硝酸反应生成硝酸盐来提供所需的金属阳离子作催化剂,而排放出大量的含氮氧化物工业废气, 处理量为40kg/d(以NO2计,2次×2小时/天),对大气环境造成严重的污染。其NOX尾气的排放同时具有间歇排放、排放量及浓度变化极大等特点,其废气的治理不同于大型的工业化硝酸生产尾气的治理,必须具备治理效果好、无二次污染、工艺流程简单、操作弹性大、平衡方便、投资少耗能低等优点。
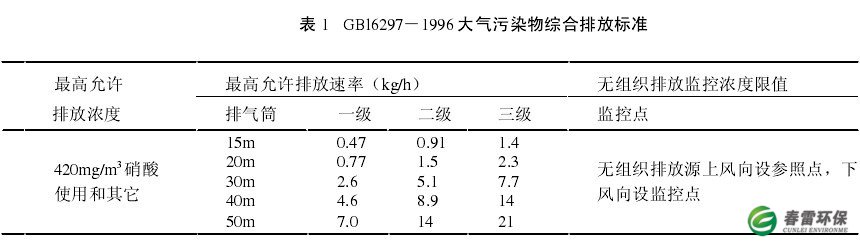
为此我们采用酸性尿素溶液来吸收氮氧化物废气,经过实验室研究和工业化运行结果证明:酸性尿素溶液的还原吸收法不失为治理间断,非均匀排放含氮氧化物(NOX)工业废气的良好的的方法,处理后尾气中的NOx达到GB16297 -19%大气污染物综合排放一级标准。排行标准见下表1:
1、原理
酸性尿素溶液还原吸收法利用还原剂尿素在酸性条件下与NOx发生氧化还原反应,最终产物为N2,CO2、和H20,且无副反应,不会造成二次污染,能达到无毒排放。反应机理如下:
6N02+4(NH2)2C0一7N2↑+4C02↑+8H20
6N0+2(NH2)2C0一SN2 ↑+2C02↑+4H20
NO+NO2一N203
N203+H20一2HN02
2HN02+ (NH2)2C0一2N2 ↑ +C02 ↑ +3H20
2、工艺参数的确定
2.1试验方案
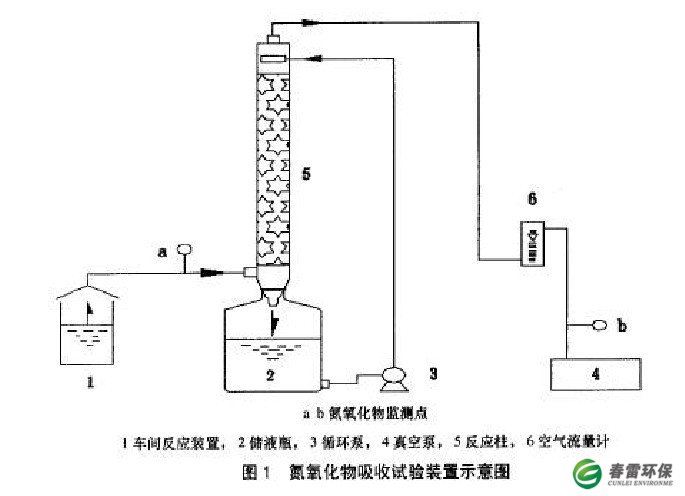
本研究在实验室主要利用如图1的试验装置完成。试验用NOX废气采用实际生产产生的废气,通过ABS工程塑料管与反应装置连接。吸收柱(5)由直径100mm的玻璃柱制成,填料为PP材料多边球。氮氧化物尾气通过水力真空泵(4)工作产生的负压由尾气产生瓶(1}经吸收柱底部进入,与酸性(以硝酸为PH值调节酸)尿素吸收液逆向接触反应后由顶部排出。吸收液通过微型泵(3}在储液瓶(2}和吸收柱问循环工作。通过转了气体流量计(6)来控制通过吸收柱的气体流量,以此来达到控制反应时问的目的。a,b点为模拟废气的进出浓度检测点。
2.2仪器、药品
仪器:721分光光度计,PHS-3C精密酸度计,白制大气采样器(0~1L/min)双球玻璃管
药品:对氨基苯磺酸,冰醋酸,盐酸蔡乙二胺,粒状亚硝酸钠,三氧化铬,硝酸,尿素。
2.3检测方法
采用负压方式进行氮氧化物的吸收,具体采集方法参照GB / T 13906 92《空气质量一氮氧化物的测定》的气体采集方法。处理前后气体的采集连续,不问断。氮氧化物的检测采用盐酸蔡乙二胺比色法进行测定氮氧化物的去除率由如下公式计算。
NOx去除率=(处理前NOx含量一处理后NOx含量)/处理前NOx含量X 100%
其中的标准曲线的绘制方法为:配制吸收原液和亚硝酸钠标准溶液,用721分光光度计测定吸光度,以吸光度为纵坐标、相应的标准溶液中NO2含量为横坐标,绘制标准曲线(NO2一含量。0-3up /5ml),得回归方程y=0.1874x+0.00472,其线性相关系数为0.99820
2.4结果与讨论
根据相关参考文献,选择吸收液温度、吸收液尿素浓度、吸收液PH值和反应时问为主要影响因素,每个因素列3水平,择四因素三水平正交表L9(34)进行正交试验。因素水平表、正交试验极差分析表如下。
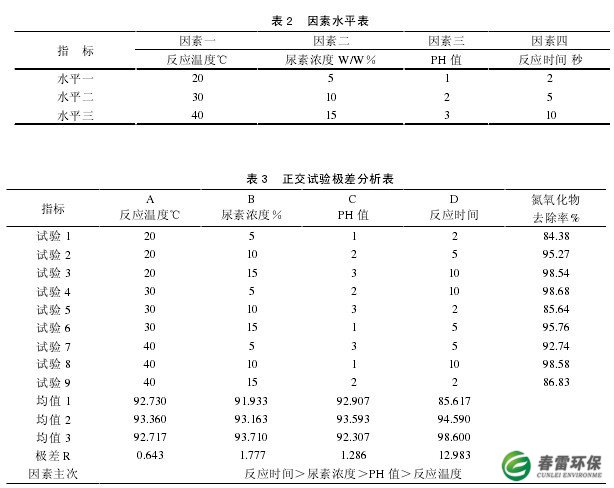
由正交试验结果及相应的极差分析结果可见:极差大小循序为反应时问>尿素浓度> PH值>反应温度。这说明反应时问对试验结果影响最大,反应温度最低。通过作效应曲线图也可见:在各水平值范围内波动时,反应时问影响因素的波动最大,尿素浓度因素波动程度其次,反应温度影响因素波动程度最小。
由此确定NOX吸收的较佳工艺条件为:尿素浓度为10%,反应温度30°C,反应时问大于5秒,吸收液PH值为2。按该工艺条件, NOX废气中NOX浓度去除率稳定在95%以上。
由以上试验结果可见,反应时问和尿素浓度是决定NOX吸收效率的两个主要因素。这是由吸收机理决定的,氮氧化物的吸收为一化学吸收过程,传质机理可以认为遵循双膜理论。由于液相有化学反应进行,可极大地提高其传质速率。传质效果的优劣主要取决于溶质在气膜中的传质速率的高低。提高气体在吸收柱内的停留时问,可提高气液界面的接触时问,从而提高其传质效率。
另外,主反应(1}是一个嫡减和放热反应,△rH0m和△rS0m气为负值。由平衡常数与温度的关系式
1nK=△rG0m/RT及化学热力学关系式△rG0m=△rH0m-T△rs0m可得:
1nK=一△rH0m/RT- ( △rS0m/R) C K为平衡常数)
可见,1nK正比于1 /T,随着温度的升高,K值下降,不利于反应的进行,反应速度下降。同时表明低温有益于氮氧化物的吸收。
同时结合Arrhenius公式,反应式(1)的反应速率常数与温度存在如下关系[f}l
lnk=-Ea/RT+1nA C k为反应速率常数;Ea为活化能;A为指前因了)
随着温度的升高,反应速度升高。这与平衡常数与温度的关系相矛盾,必须经过实验对最佳反应温度
加以确定。对于温度的确定,经过试验表明在300C去除效果最好,从操作方便角度考虑,选用室温作为反应条件。
同时应认识到,如果温度过高,尿素会发生分解,会产生难闻氨气。因主反应为放热反应,在工艺设计中,应考虑散热。尿素分解反应如下:
3、工程实践
酸性尿素溶液还原吸收处理氮氧化物废气属于湿法吸收范围,吸收过程是属于气体分离吸收的化工单元操作。吸收操作在吸收塔中进行,因此吸收的两大要素是吸收液和吸收塔,在实验室研究的基础上,按3500m³/h进行设计,工艺的设计遵循如下条件:
(1)反应温度控制在室温条件下进行,由于反应为放热反应,吸收液必须有散热装置,以免温度过高,降低体系的吸收效率;
(2)反应塔应具备较小的压降,反应塔的设计尽可能的提高吸收塔内的气液接触面积;
(3)整个工艺应有较高的操作弹性,操作方便,适合问歇性、高浓度排放的NOX废气;
(4)操作费用低于传统碱吸收法。
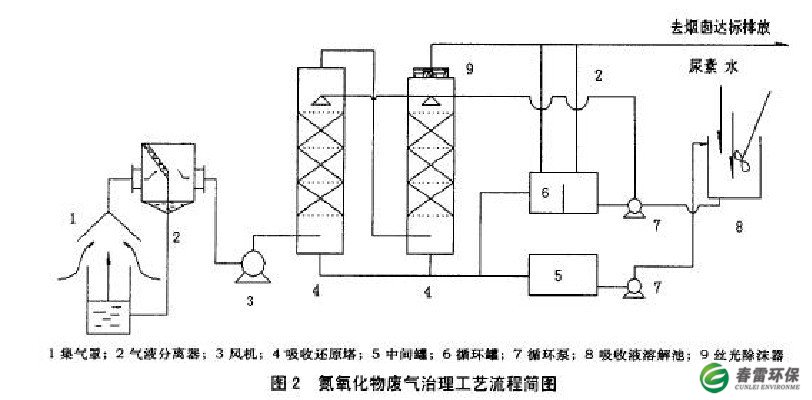
3.1工艺流程
处理工艺流程见图20氮氧化物尾气经集气罩收集后首先通过气液分离器将尾气与水雾及硝酸银液滴进行气液分离,分离下来的液滴重新回到反应桶或收集起来集中处理,尾气进入两级吸收还原反应塔与尿素溶液逆流接触,充分反应,反应后的尾气经循环罐降温后,分离后的无毒无害尾气最后排入烟囱放空。
治理过程中,尿素被逐步消耗掉,利用NOX问断排放的问隙把浓度降低了的尿素溶液放到中问罐,把浓度符合要求的尿素溶液补充到吸收塔和循环罐内,浓度降低了的尿素液再从中问罐打回溶解罐溶解尿素,补加一定量的尿素溶解后待用,如此闭路循环利用,使废气得以治理,又不造成新的污染。
3.2主要工艺特点
(1)使用气液分离器对尾气进行气液分离,使尾气中硝酸银液滴充分回收。
(2)尿素吸收分解还原法属于纯消耗型废气治理方法,吸收完成后的废液经中问罐重新回到尿素溶解罐,不再消耗水,不产生污染的废弃水体,也不发生任何二次污染,节约了能源。
(3)反应条件温和,在常温下即可达到97%以上的去除率;
(4)反应器内气液具有较高的接触面积,传热、传质十分理想。二级吸收还原充分保证尾气的达标排放;
(5)整个系统设计紧凑,占地面积小,采用控制柜控制,维护方便,操作简单、弹性大。
(6)避免了传统水洗法、碱吸收法、选择性催化氨还原法等工艺存在的酸性污染水体、NaNO2和NaN03副产品难以回收、副反应多、Cu-Cr催化剂烧结、设备内部构件烧结等问题。尿素吸收分解还原法与其它方法相比具有工艺简单、适应性强、操作方便且弹性大、治理成本低等优点,尤其适合于治理排放量极不稳定的NOX发生源,能白分之白的与生产装置同步开车运行。
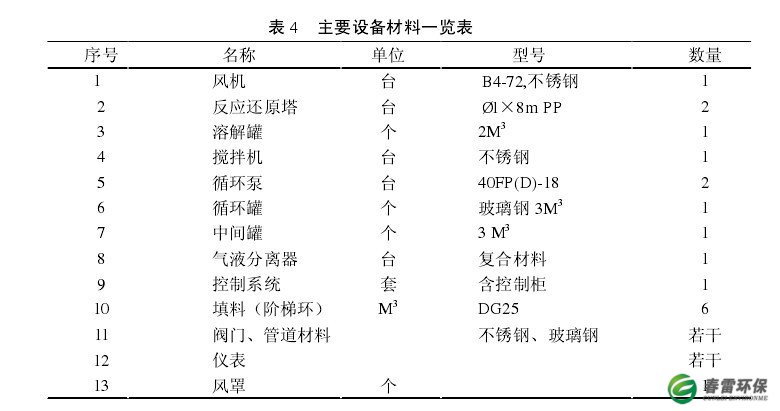
3.3主要设备材料一览表
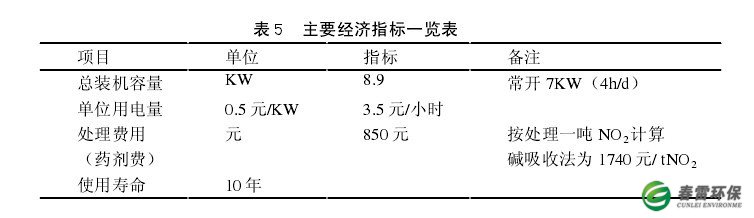
3.4经济指标一览表
4、结语
采用本技术和设计处理实际氮氧化物废气,废气中NOX浓度经两级吸收塔吸收后,NOX浓度稳定从2857mg/m³-4285 mg/m³降为85.7mg/m³-128 mg/m³,排放速率在0.299 kg/h~0.45kg/h之问,达到了GB16297一1996大气污染物综合排放一级标准,具有处理费用低,无二次污染,氮氧化物去除效率高等特点。